【アクテムラとわが研究人生 vol.28 2つの結果オーライ】
2025.03.11
2つの結果オーライ
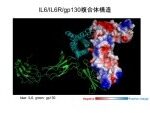
IL6/IL6R/gp130複合体モデル:Protein Data Bankに登録されているhIL6/hIL6R/gp130の複合体構造(ID:1P9M)の座標ファイルと、
描画ソフトPyMolを 用いて作成。IL6とIL6Rの結合が面同士の会合であり、鍵と鍵穴は見いだせない
(提供元:カン研究所・中谷竜の介博士)
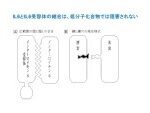
低分子化合物ではIL6/IL6R複合体形成は阻害できないことを説明する模式図(筆者作成)。(A):両分子が広範囲にわたって会合し、
その界面面積は低分子化合物の数十倍から100倍広い。(B):酵素と基質蛋白質の結合は、鍵と鍵穴の関係にあり、
低分子化合物が酵素側にある鍵穴に入り込んで阻害する
IL6阻害剤の探索を目指しながらも、可溶性受容体では挫折し、低分子量のペプチド性化合物の探索でも苦戦した揚げ句、IL6受容体に対するモノクローナル抗体の開発にかじを切ったことを述べてきたが、この選択が結果オーライだったと思える点が2つある。
1つ目は、結論を先に言うが、我々が選択したIL6受容体抗体はIL6そのものを阻害する抗IL6リガンド抗体と比べて「勝るとも劣らない」との結論に達したことである。知的財産の独占的実施権を持っている受容体抗体を開発する以外に我々としては選択の余地が無かったのだが、もしも、逆の結果が出ていれば、IL6阻害剤を目指したBFプロジェクトはここで頓挫したであろうから、ここでも私の運の強さが出たことになる。
受容体抗体との活性比較のため、ヒトIL6(リガンド)に対するマウスモノクローナル抗体が、斎藤浩之さんと小石原保夫さんが中心となって作製された。チームの三原昌彦さんは動物実験手技にたけた免疫薬理研究者であることは以前に紹介済みであるが、彼が実施したマウスでの実験は大変興味深いものだった。マウスを蛋白抗原で免疫して誘導される抗体の産生量を定量するという実験系で、IL6の注射により蛋白抗原に対する抗体量が増幅される、すなわちIL6がB細胞を活性化して抗体産生量を増やしたことを確認した。一方、IL6と抗IL6受容体抗体とを投与した群においては抗体量の増幅が無い、すなわちIL6の作用が抗IL6受容体抗体の投与によって強く抑制されたが、IL6と抗IL6(リガンド)抗体を投与すると逆に蛋白抗原に対する抗体の産生をさらに増強したという結果であった。そこで血中のIL6量を測定したところ、抗IL6(リガンド)抗体とIL6との免疫複合体が長時間にわたって血中で持続して存在することが分かった。このような結果から、抗IL6(リガンド)抗体はIL6と結合してモノメリックな免疫複合体を形成し、血液中を長時間循環するため、あたかも半減期の短いIL6の血中持続時間延長を狙ったDDS製剤のごとき振る舞いをし、IL6の作用を結果的に増強するからであると考えられた(Mihara et.al.,Immunology 1991)。
抗IL6(リガンド)モノクローナル抗体の多発性骨髄腫治療薬としての可能性について研究していたオランダのアムステルダム赤十字輸血サービスのAarden博士らも同様の結果を出しており、モノクローナル抗体では阻害効果が得られないので、IL6上の異なるエピトープを認識する数種類の抗体のカクテルの使用やIL6のワクチン療法について検討していると報告している。この試みがその後どうなったのか結末は知らないが、そういうこともあってAarden博士らは、岸本先生を介してMRAへの興味を表し、私にコンタクトを求めてきた。1991年10月21-22日にスイスのモントレーで開催されたスイスSerono社主催の「IL6国際シンポジウム」会場で初めて顔を合わせ、その足でアムステルダムに向かい共同研究についてディスカッションした。その中で彼は、「抗IL6抗体は、体内でのIL6産生を増強するので、いたちごっこになり、治療がうまくいかない。MRAも一緒ではないかと思う」とコメントした。しかし、彼の予言は外れて幸運なことにMRAではそのようなことは起こらないことが後になって動物実験で証明されているし、臨床でもIL6産生が誘導されるとの報告は無い。リガンド抗体と受容体抗体の運命の分かれ道であった。
実際、他グループにより抗IL6(リガンド)モノクローナル抗体の臨床開発が進められていることが最近発覚し、アクテムラの強力なライバルになるのではないかと心配したが、今のところ、アクテムラの脅威となるような臨床効果が得られないようである。うまくいかない理由として、上述したような原因が考えられるが詳細は分からない。
もう1つの結果オーライは、IL6とIL6受容体との結合を阻害するのは抗体以外では不可能であるということが、後になって分かったことである。研究本部の「選択と集中」の荒波が巻き起こり、苦肉の策として提案した抗体医薬であったが、これが的を射た選択であったのである。この時点で低分子化合物のスクリーニングを継続実施する時間的余裕が無かったことが幸いしたのである。
抗体医薬に焦点を絞って開発を進めていたものの、実は、大いに心配していたことは、抗体医薬の開発に成功したとしても、後からすぐに低分子化合物が台頭してくるのではないかという恐れである。それで、チームメンバーの秋元利夫さんはMRCとの共同研究が始まる前年、すなわち89年、ランダムスクリーニングによって多くの低分子化合物の中から、IL6とIL6受容体の結合を阻害するリード化合物を探し求めたのであるが、徒労に終わり、ヒットらしいヒットは全く得られなかった。
この時から30年たった現在でもIL6を阻害する低分子化合物の報告は世界中を探しても見当たらない。その理由は2002年Vargheseら(PNAS.99,15959)、および05年Skiniotisら(Nat. Struct Mol Biol,12,545)によって、IL6とIL6受容体の複合体の結晶構造が解明されて明らかになったが、鍵と鍵穴のような結合様式ではなく、平面的で、しかもかなり広範囲にわたって両分子が面と面同士で結合しているので、小分子化合物では阻害できないと考えられている(図参照)。従って、今後もIL6を阻害する低分子化合物が発見・発明される可能性は無いだろう。IL6とIL6受容体との結合を阻害するのは抗体のような分子以外では難しく、今にして思えば、極めて的を射た選択であったと自画自讃している。
初出:日経バイオテクONLINE 2017年3月27日掲載。日経BPの了承を得て掲載










